ラボラトリーズ
最先端研究開発支援プログラム「心臓シミュレータによる最適医療」 に関して
2013年03月09日
岡田 純一
おかだ じゅんいち
東京大学大学院新領域創成科学研究科
筆者を含む東京大学大学院新領域創成科学研究科・久田俊明教授,杉浦清了教授,鷲尾巧研究員の研究チームは,9年間に亘ってマルチスケール・マルチフィジックス心臓シミュレータUT-Heartの研究開発を続けてきた[1].最近では,スーパーコンピュータ“京”などの超並列計算機を活用した基礎医学的研究と併せて,心臓シミュレータの医療への実用化に向けた取り組みを進めている.内閣府・最先端研究開発支援プログラム30課題の一つ「未解決のがんと心臓病を撲滅する最適医療開発(中心研究者 自治医大・永井良三学長)」のサブテーマである「心臓シミュレータによる最適医療」は,心臓シミュレータの臨床応用を目的としたプロジェクトである.ここでは本プロジェクトの中心的課題の一つである心臓再同期医療法の最適化を紹介する.
心不全の治療法には薬物療法,非薬物療法があるが,薬物による治療には限界が指摘されており,CRT(心臓再同期療法)によるデバイス治療に期待が寄せられている.CRTとは,両心室に設置した電極から心筋に電気刺激を与えることにより不全心筋の収縮を同期させる治療法のことで,薬物治療に較べて予後の生存率が高いことが報告されている.従来の薬物治療が心臓のエネルギーを浪費する治療であるのに対し,このCRTは心臓のエネルギーの有効利用ができるという点で画期的である.しかし植え込み手術が必要であること,機器が高価であることを考えると,効果が期待できる症例であるか否かを事前に判断する必要がある.また,患者ごとに最も適した植え込み法,刺激法を決定する必要がある.我々は,この問題の解決に心臓シミュレータの活用が有効であると考え,CRTの電極位置・通電タイミングのオーダーメイド最適化システムを開発している[2].心臓電気現象の数理モデル化,及び解析方法については[3],[4]に詳しい.
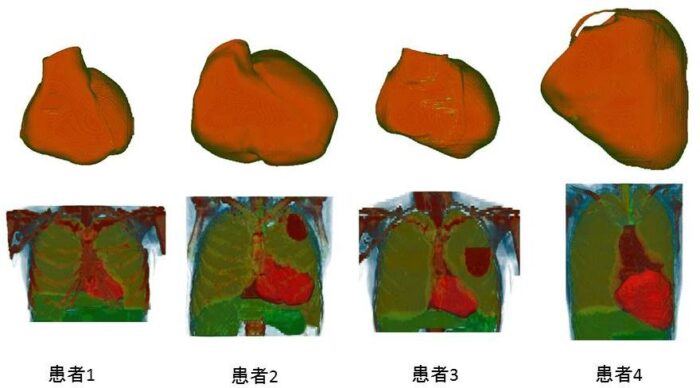
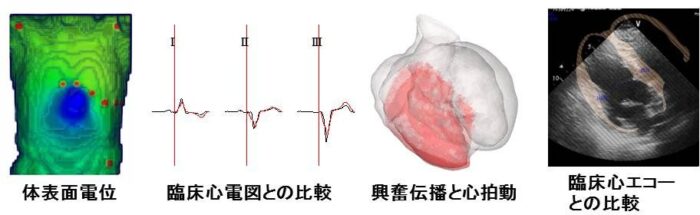
心臓シミュレータをCRTに応用するためは,患者個別の心臓と病態を再現する必要がある.先ずCT画像等の臨床データに基づき患者個別の心臓・トルソ(胸郭)の形状モデルを作成する(Fig.1参照).次にFig.2に示すように患者から取得した心電図・心エコーと一致するようにシミュレータを調整することによりその電気的・力学的同一性を担保する.この患者の個別心臓シミュレータに対しコンピュータ上で仮想的な治療を施し,効果を予測することにより,治療法の最適化を行う.既に「後ろ向き研究」(過去の臨床データに基づく研究)として10例を超える患者データに対してシミュレータの適用を行っており,さらに検証を進め実用化を目指す.
電気解析は数千万(ボクセルメッシュ),力学解析は数百万(テトラメッシュ)の自由度を有するため,何れも100コア程度の並列計算を行っている.CRT電極設置位置・通電タイミングと心電図・心拍出能の関係は,複雑な非線形性を有するため,最適化を行うためには,多数の解析を行うことが必須となる.我々は今年度末にIntel Xeon E5-2670 296ノード(4736コア)からなる大規模計算機を導入する予定である.これにより,同時に30~40ケース程度のシミュレーションを並行して実行することが可能になり,臨床データの再現と治療の最適化解析を臨床の実務に耐えうるレベルまで高速化することが可能になると考えている.この際,最適化を自動化するための探索アルゴリズムに関しても検討中である.
さらに臨床研究を加速し実用化するために,「マルチモダリティ診断システム」の試験運用を今年度中に開始する予定である.東京大学附属病院の医療情報システムと心臓シミュレータ(上記の大規模計算機)をオンラインで接続することにより,病院からは臨床医療データや試すべき治療条件を送信し,これに対しシミュレーション結果を返信することにより,担当医が数ある治療オプションの中から最適なものを選択することが可能になる.真の実用化に当っては無論,検証が必要である.今後は,動物実験による検証を重ねると共に,UT-Heartを用いた診断と治療の統計的優位性を臨床医学的に実証していく必要がある.生体は人知を超えて複雑なシステムを構成しており,シミュレーションが総てを表し得るわけではない.しかしながら,計算科学が従来の概念を超えた新たな医療の道を拓き,実際に医療に貢献できる時代に入ったことは明らかと言える.
[1] Sugiura S, Washio T, Hatano A, Okada J, Watanabe H and Hisada T (2012) Multi-scale simulations of cardiac electrophysiology and mechanics using the University of Tokyo heart simulator. Progress in Biophysics and Molecular Biology 110 :380-389.
[2] Okada J, Sasaki T, Washio T, Yamashita H, Kariya T, Imai Y, Nakagawa M, Kadooka Y, Nagai R, Hisada T and Sugiura S(2012) Patient Specific Simulation of Body Surface ECG using the Finite Element Method, Pacing and Clinical Electrophysiology, in print.
[3] 岡田純一,”心電図の数理” 応用数理 Vol.22 No.4 (2012) pp.238-246.
[4] Washio T, Okada J and Hisada T (2010) A Parallel Multilevel Technique for Solving the Bidomain Equation on a Human Heart with Purkinje Fibers and a Torso Model. SIAM Review, 52(4) pp. 717-743.
謝辞
本プロジェクトは東京大学医学部附属病院の協力の下に進められており,倫理委員会の承認を得て臨床データの提供を受けている.また富士通(株)次世代テクニカルコンピューティング本部・アプリケーション統括部は,このプロジェクトにおいては主にプリ・ポストプロセスを担当し,短時間で患者個別の心臓・トルソモデル作成を行う手法を開発している.ここに感謝の意を表する.
